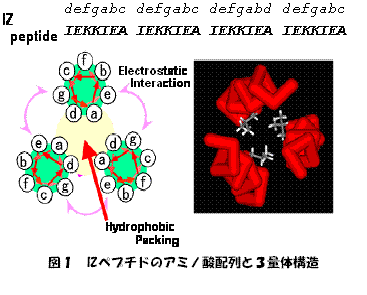
 コイルドコイル構造は、はじめトロポミオシンのような繊維状蛋白質の構成成分として天然蛋白質の配列の中から見いだされていたが、やがて、1988年にS. L. Mcknight、R. Tjianらにより天然の転写因子蛋白質としてよく知られるGCN4, Fos, Jun, Myc等の中に見られるLeucine Zipper構造として知られるようになった。長さにもよるが、基本的には水溶性の会合性蛋白質であり、疎水場に含まれるLeu、Ile等の疎水性残基間の疎水性相互作用とヘリックス間の界面における静電相互作用などを駆動力に、2から5本の右巻きのα−ヘリックスが左巻きに束なった、スーパーコイル構造を取る。2量体型コイルドコイルはLeucine Zipper構造として広く知られているが、3量体型については天然にはマクロファージスカベンジャーレセプター、バクテリオファージのgp41、ヒートショック転写因子などにおいて知られている。これらの天然配列は、コイルドコイル構造の形成に重要な全ての相互作用が効果的に働くようにアミノ酸残基が配置されている訳ではない為、ラショナルな最適化からIsoleucine Zipper(IZ)ペプチドをオリジナルにデザインした(図1)。このペプチドは非常に安定であり、融解温度は95℃を超える。
コイルドコイル構造は、はじめトロポミオシンのような繊維状蛋白質の構成成分として天然蛋白質の配列の中から見いだされていたが、やがて、1988年にS. L. Mcknight、R. Tjianらにより天然の転写因子蛋白質としてよく知られるGCN4, Fos, Jun, Myc等の中に見られるLeucine Zipper構造として知られるようになった。長さにもよるが、基本的には水溶性の会合性蛋白質であり、疎水場に含まれるLeu、Ile等の疎水性残基間の疎水性相互作用とヘリックス間の界面における静電相互作用などを駆動力に、2から5本の右巻きのα−ヘリックスが左巻きに束なった、スーパーコイル構造を取る。2量体型コイルドコイルはLeucine Zipper構造として広く知られているが、3量体型については天然にはマクロファージスカベンジャーレセプター、バクテリオファージのgp41、ヒートショック転写因子などにおいて知られている。これらの天然配列は、コイルドコイル構造の形成に重要な全ての相互作用が効果的に働くようにアミノ酸残基が配置されている訳ではない為、ラショナルな最適化からIsoleucine Zipper(IZ)ペプチドをオリジナルにデザインした(図1)。このペプチドは非常に安定であり、融解温度は95℃を超える。
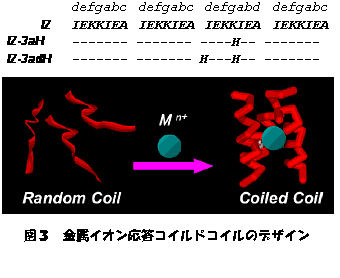 天然のコイルドコイル蛋白質においては、密な疎水相互作用が疎水場で形成されており、一般に溶媒、イオンなどは中に取り込まれることはない。これは、疎水場に於ける密な疎水パッキングがコイルドコイル形成において非常に重要である事を示している。しかしながらこれを裏返せば、この疎水場を旨くデザインできれば、僅かな相互作用により、蛋白質構造の劇的な変化(スイッチ)が可能となることが期待できる。そこで我々はこの疎水場に注目し、いくつかのIleをHisに置き換える事で、金属配位能を持たせる事を試みた。金属イオン不在下においては、疎水パッキングが崩れる事によりコイルドコイル構造は形成できず(ランダム構造)、金属イオン配位後は、錯形成に伴うエネルギーの利得によりコイルドコイル構造を形成できる事を期待した。デザインした配列は図3に示した。疎水場のIleを1つHisに変異をかけたIZ-3aHは、金属イオン依存的にコイルドコイル構造が形成される事が示された。この際の選択性は、Cu2+>Zn2+>>Ni2+であった。一方で2つHisに変異をかけたIZ-3adHについても金属イオン依存的なコイルドコイル構造の形成が観測されたが、選択性はNi2+〜Cu2+>>Zn2+であった。また、この2つは旨く一つの蛋白質に内に組み合わせる事により、異種金属を配位できるコイルドコイル蛋白質のデザインも可能である事が分かった。
天然のコイルドコイル蛋白質においては、密な疎水相互作用が疎水場で形成されており、一般に溶媒、イオンなどは中に取り込まれることはない。これは、疎水場に於ける密な疎水パッキングがコイルドコイル形成において非常に重要である事を示している。しかしながらこれを裏返せば、この疎水場を旨くデザインできれば、僅かな相互作用により、蛋白質構造の劇的な変化(スイッチ)が可能となることが期待できる。そこで我々はこの疎水場に注目し、いくつかのIleをHisに置き換える事で、金属配位能を持たせる事を試みた。金属イオン不在下においては、疎水パッキングが崩れる事によりコイルドコイル構造は形成できず(ランダム構造)、金属イオン配位後は、錯形成に伴うエネルギーの利得によりコイルドコイル構造を形成できる事を期待した。デザインした配列は図3に示した。疎水場のIleを1つHisに変異をかけたIZ-3aHは、金属イオン依存的にコイルドコイル構造が形成される事が示された。この際の選択性は、Cu2+>Zn2+>>Ni2+であった。一方で2つHisに変異をかけたIZ-3adHについても金属イオン依存的なコイルドコイル構造の形成が観測されたが、選択性はNi2+〜Cu2+>>Zn2+であった。また、この2つは旨く一つの蛋白質に内に組み合わせる事により、異種金属を配位できるコイルドコイル蛋白質のデザインも可能である事が分かった。
コイルドコイル構造は、はじめトロポミオシンのような繊維状蛋白質の構成成分として天然蛋白質の配列の中から見いだされていたが、やがて、1988年にS. L. Mcknight、R. Tjianらにより天然の転写因子蛋白質としてよく知られるGCN4, Fos, Jun, Myc等の中に見られるLeucine Zipper構造として知られるようになった。長さにもよるが、基本的には水溶性の会合性蛋白質であり、疎水場に含まれるLeu、Ile等の疎水性残基間の疎水性相互作用とヘリックス間の界面における静電相互作用などを駆動力に、2から5本の右巻きのα−ヘリックスが左巻きに束なった、スーパーコイル構造を取る。2量体型コイルドコイルはLeucine Zipper構造として広く知られているが、3量体型については天然にはマクロファージスカベンジャーレセプター、バクテリオファージのgp41、ヒートショック転写因子などにおいて知られている。これらの天然配列は、コイルドコイル構造の形成に重要な全ての相互作用が効果的に働くようにアミノ酸残基が配置されている訳ではない為、ラショナルな最適化からIsoleucine Zipper(IZ)ペプチドをオリジナルにデザインした(図1)。このペプチドは非常に安定であり、融解温度は95℃を超える。