研究内容
「Bio-functional Molecular Engineering」、「Bio-functional Materials Engineering」を研究の守備範囲として、生体内で機能する新規分子、新規材料の開発、生体機能(すなわち生理活性)を有する新規分子、新規材料の開発を目指して研究を進めております。なお、利用する分子の対象は、主に合成化学にて調製可能な有機小分子やペプチド、高分子重合反応で調製が可能な合成高分子、遺伝子工学、蛋白質工学的の技術で調製が可能な核酸(DNA、RNAなど)、蛋白質などを含みます。
- 外部刺激に応答する人工蛋白質の開発
- 基質結合能を有する人工蛋白質の開発
- 膜蛋白質の新規可溶化試薬、抽出試薬の開発
- 膜蛋白質のデバイス化に資する新規分子の開発>
- 蛋白質や機能性核酸などの生理活性を保持した新規バルク材料(フィルムやメソポーラス材料)の開発
- 蛋白質のナノ組織化に資する手法の開発
1.外部刺激に応答する人工蛋白質の開発
外部刺激(温度、光、イオン、薬剤などの小分子、ペプチド、蛋白質、DNA、RNAなどの核酸等)に応答し、自身の保持する生理機能が変化する蛋白質を開発することは、「生体内で意図する刺激を感知可能なセンサー蛋白質の構築」、あるいは生体内での「特定の遺伝子回路に対するturn-on、turn-offを可能とする人工エフェクター分子の開発」などへの利用が期待され、特にケミカルバイオロジーの研究分野における分子ツールとして有用です。このような分子の基本的な設計指針は、例えばセンサー蛋白質を設計するためであれば、外部刺激を感知する機能を持つ蛋白質と、酵素活性や蛍光発光などの(通常の検出器での検出が容易な)物理信号を発する蛋白質を適切に組み合わせたハイブリッド蛋白質を設計すれば可能となり、様々な人工蛋白質が多くの研究者によっても開発、報告されてきています。 これまでに我々の研究室では、イオンの結合や特定のペプチドとの結合により大きく立体構造の変化するデノボコイルドコイル蛋白質を、外部刺激を感知する機能を持つ蛋白質ユニットとして利用し、種々の外部刺激に応答する人工蛋白質の創成を行っております。
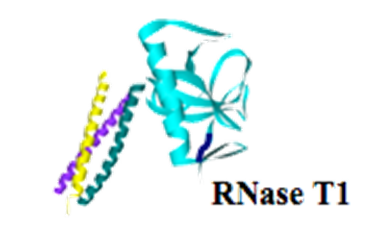

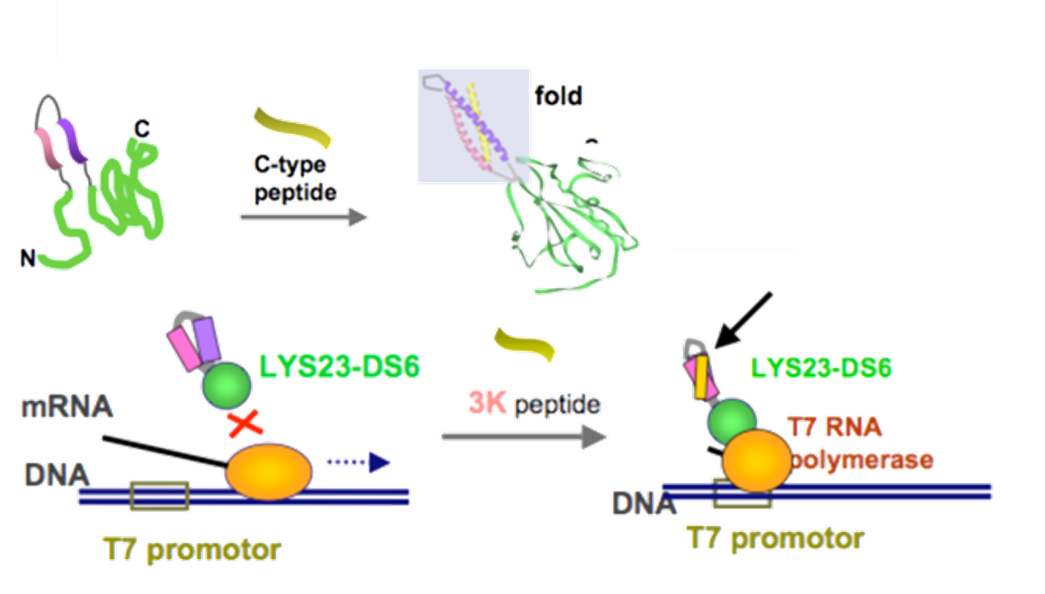
2.基質結合能を有する人工蛋白質の開発
1.のところの刺激応答性人工蛋白質の開発に関連するところですが、実は特定の分子の結合に応じて立体構造の大きく変化する天然蛋白質は限られており、このような機能を持つ蛋白質ドメインを新たに開発することが、種々の刺激応答性蛋白質構築において鍵となります。 我々はこのことを念頭に、デノボ設計された4本鎖コイルドコイル蛋白質(GCN4-pLI)の中心部にあたる疎水性部位に、アラニン変異により空孔を設けた人工蛋白質の開発を行いまいした。その結果、空孔サイズ的に、アダマンタン程度の分子がこの空孔にちょうどフィットし高い結合定数が見られました(すなわち、リガンド結合性蛋白質のデノボ開発に成功しました)。また興味深いことに、本来構造欠陥のない蛋白質構造内部に空隙を設けたわけですから、元々の蛋白質に比べて構造安定性の減少が見られましたが、ここをリガンドの結合により埋めることで、蛋白質の構造安定性もあがりました。残念ながら、リガンド結合によって蛋白質構造を大きく変化させるデノボ蛋白質の設計にはまだ成功しておりませんが、リガンド結合により蛋白質の構造安定性を変化させる手法を明らかにしたことは、今後の分子設計につながると考えられます。
3.膜蛋白質の新規可溶化試薬、抽出試薬の開発
膜蛋白質は天然蛋白質の約3分の1を占め、おもに生体膜での生命現象において重要な役割を果たしています。このような膜蛋白質の機能評価を行う方法には、生体膜に埋め込んだまま細胞や組織単位で評価を行う方法、あるいは強制発現により特定の膜蛋白質の細胞内での発現量を変化させる方法などもありますが、やはりまずは生体膜から目的とする膜蛋白質のみを単離精製し、この生理活性をin vitro環境下で評価を行うこと、さらに単結晶を作製しX線結晶構造解析により立体構造を明らかとすること(これにより構造と機能の相関を明らかにする)などが王道となります。しかし通常膜蛋白質は生体膜に埋まり水中に溶け出してこないことから分かるように、大部分を占める膜貫通領域表面は疎水性で水に溶けません。したがって、このような膜蛋白質を生体膜から単離精製するためには、まずは生体膜を乱して(溶かして)膜蛋白質を引き抜き(この際に蛋白質を変性させてはダメです)、さらに水緩衝液中で凝集させることなく分散させることが必要となります。この両方の役目を果たすには界面活性剤が適しており、中でも膜蛋白質の変性を抑えつつこの両方を可能とする試薬が、膜蛋白質可溶化試薬と呼ばれる試薬となります。現状の問題点としては、このような特殊な必要要件のため、使用可能な試薬の数が限られており、中には生体膜から変性させることなく取り出すことができない膜蛋白質も知られているため、(試薬の選択肢を増やせるよう)新規試薬の開発が望まれています。
そこで我々は、ペプチドに2本のアルキル鎖を修飾したペプチドジェミニ界面活性剤(PG-surfactant)の中から、この目的を満たす試薬開発をすることに着目し検討を進めました。今後さらにペプチド配列をスクリーニングすることで、利用可能な試薬はまだまだ増やせると期待されるのですが、現在までに、以下の3種類のペプチド配列をもつ試薬について、新規の膜蛋白質可溶化試薬、抽出試薬として利用可能であることを明らかにし報告しています。
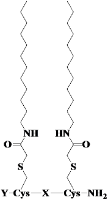
| PG-surfactant | Y- | -X- | 機能 |
|---|---|---|---|
| DKDKC12K | Ac-Lys- | -Asp-Lys-Asp-Lys- | 膜蛋白質の可溶化 |
| DKDKC12D | Ac-Asp- | -Asp-Lys-Asp-Lys- | |
| NPDGC12KK | Ac-(Lys)2- | -Asn-Pro-Asp-Gly- | 膜蛋白質の抽出と可溶化 |
また、このPG-surfactantベースの膜蛋白質可溶化試薬は、アミノ酸が通常のアミド結合で縮合された単なる直鎖状リポペプチドであるが故に、柔軟なリンカーペプチド配列を間においた、より長い(分子量の大きな)膜蛋白質可溶化試薬の分子設計も容易です。具体的に検討し報告を行っている分子構造を、下の図に示します。上の方で説明をしたDKDKC12Kなどにおける、コの字型のリポペプチド部分(ジェミニ構造のところ)が膜蛋白質と直接的に相互作用する部位と考えられますので、この部分を2つ、3つと連結したとしても、DKDKC12Kなどと膜蛋白質の間の相互作用様式は同じと考えられます。したがって、多量化により1分子内のアルキル鎖の数が増えることで膜蛋白質との相互作用が強くなり、DKDKC12Kなどよりもさらに1,2桁低い濃度でも膜蛋白質の可溶化を可能とする試薬の開発に成功しました。おそらく、少なくともこれまでに報告されている膜蛋白質可溶化試薬の中では、単一分子量を持つものでこれらが最も分子量の大きいものと思われます。
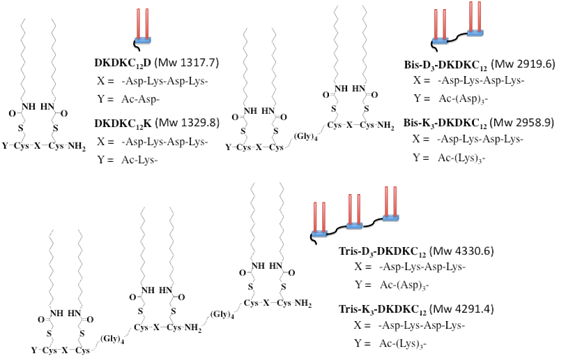
これらのジェミニ部分を多量化することで得られた、分子量の大きな膜蛋白質可溶化試薬
4.膜蛋白質のデバイス化に資する新規分子の開発
5.蛋白質や機能性核酸などの生理活性を保持した新規バルク材料の開発
6.蛋白質のナノ組織化に資する手法の開発
天然では、DNAやRNAを内包し細胞感染力を持つウイルスキャプシド、鉄イオンを内部に取り込んで貯蔵するフェリチン、炭素固定に関与する酵素を内包するカルボキシソームといった、「蛋白質のみから構成される蛋白質ケージ(カプセル)」が重要な役割を果たしている例がいくつか知られています。このような系は様々な応用研究につながると期待され、合成生物学的にもバイオナノ材料科学的にも非常に興味が持たれています。しかし一方で、このような「蛋白質の集合状態をデザインする(すなわち蛋白質の4次構造の設計する)」ことは依然として非常に難しく、これまでに報告のある蛋白質ケージの系は、いずれも元々カプセル形成能を保持することが分かっている天然蛋白質を改変したものに留まっているのが現状です。そこでここでは、蛋白質工学のみに基づく手法とは異なりますが、疎水性の合成高分子を付加することで、蛋白質の集合状態を制御する検討を行いました。
疎水性の合成高分子に親水性の蛋白質を付加することで両親媒性分子した複合体のことは、低分子の両親媒性化合物と区別して、J.M.NolteらによりGiant
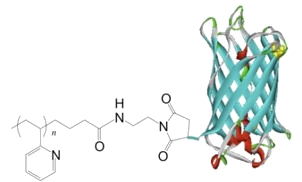
Amphiphileと名付けられました。しかし(あくまでこの研究報告を行うまでだったかもしれませんが)、それまでに報告されていたものは、蛋白質表面に疎水性の高分子を付加(あるいはGraft-On-to法にて蛋白質表面からモノマーを重合し伸ばす)したものが偶発的に形成する会合体について検討しているものが主でした。そこで本研究では、pH変化に依存し疎水性-親水性の変化するポリ2−ビニルピリジン(p2VP)の性質に着目し、弱酸性条件下で水溶性のp2VPを蛋白質に導入しつつ、その後の中和によりp2VPユニットを疎水性に変化させる過程をコントロールすることで、蛋白質集合体の形成制御を試みました。
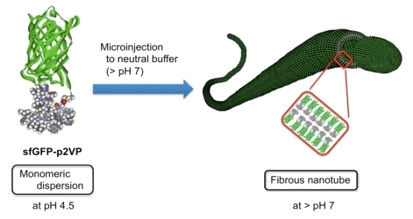
用いる蛋白質には緑色蛍光タンパク質(GFP)を用い、GFPのC-末端側にリンカーとなる数残基のペプチド配列を介して水溶性のp2VPを導入しました(GFP-p2VP、図1)。考えられる集合形態は色々とあったのですが、ここではマイクロシリンジを用いナノチューブ状に集合させる検討を試みました(図2)。pH4.5のバッファー水溶液中に溶解しているGFP-p2VPを、pH7のバッファー水溶液中にインジェクトし、溶液中の動的光散乱(DLS)測定を行ったところ、ナノチューブ化されなかった10
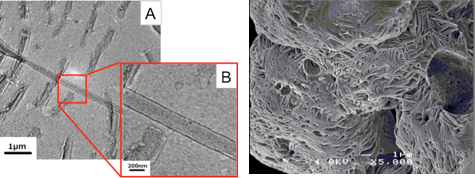
nm以下の分画の他に、1000 nm程度の粒径を持つ大きな会合体の形成が確認されました。そこで、この大きな粒径をもつフラクションをサイズ排除クロマトグラフィー(SEC)により単離し、電子顕微鏡(TEM、SEM)による測定を行ったところ、直径200
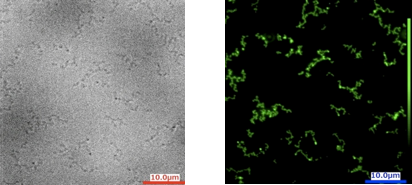
nm、長さ1〜10 µm程度のナノチューブが形成されていることが明らかとなりました(図3)。得られたナノチューブのサイズは光学顕微鏡の光学分解能の範囲内にあるため、位相差顕微鏡、蛍光顕微鏡からもファイバー状のチューブの形態は確認できました。またチューブを作製する溶液中に蛍光色素を添加しておくことでチューブ内部への内包がみられ、これをSECにより単離しても内部の蛍光色素は失われなかったため、チューブの両末端は閉じ、カプセル様の性質を保持していることもわかりました。ここではGFPのみを用いた検討でしたが、この方法は様々な天然蛋白質にも適応可能であり、今後様々な機能を持った蛋白質ナノチューブの作製に応用できると期待されます。
 |
 |
|
| 図1GFP-p2VPの構造 | 図2 マイクロ流体合成法による 蛋白質ナノチューブの作製 |
|
 |
 |
|
| 図3GFPナノチューブのTEM画像(左)とSEM画像(右) | 図4GFPナノチューブの位相差顕微鏡画像(左)と 蛍光顕微鏡画像(右) |