![]()
-謝辞-
なお、本研究は名古屋工業大学で行われたものであり、研究の推進に非常に多くの学生の献身的な協力を頂きましたことを、厚く感謝いたします。
1.ヘテロアレーンスルホニル基を用いる反応
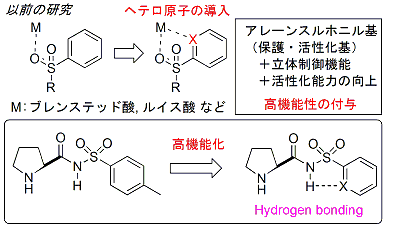
アレーンスルホニル基は、アミンの保護基、イミンへの求核付加反応の活性化基として用いられ、全合成・生理活性物質合成において広く利用される官能基です。
我々は、このアレーンスルホニル基の適切な位置にヘテロ原子を組み込むことにより、本来の保護・活性化基としての役割だけではなく、活性化能力の向上、立体制御機能を付与した高機能型スルホニル基の創成が可能になると考え、研究に取り組んできました。
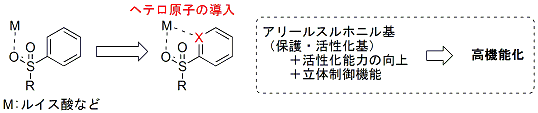
そこで、ヘテロアレーンスルホニル基を利用する不斉合成手法として、まず、イミンの活性化基としての利用を検討してみました。
イミンへの不斉求核付加反応は、光学活性なアミン、アミノ酸誘導体などを与えるため、医薬品製造などにおいて非常に重要な反応です。
しかしながら、十分な活性化能力、立体制御能力を持たない場合が多いため、その根本解決を狙いました。
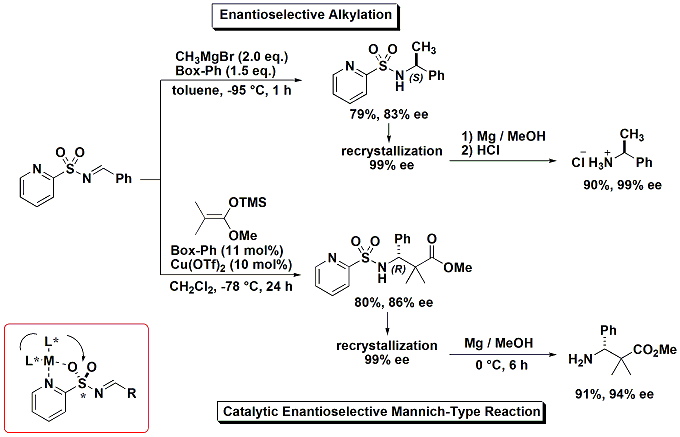
まず、求核剤としてGrignard試薬を用い、不斉配位子としてビスオキサゾリンを用い、ヘテロアレーンスルホニルイミンへの反応を行うと、高エナンチオ選択的に反応が進行しました。この反応は世界で初の高エナンチオ選択的なイミンへのGrignard試薬の付加反応例です(下図)。
また、シリルケテンアセタールとのMannich形反応を検討すると、高エナンチオ選択的に反応が進行し、β-アミノエステル類が得られました。
これらの化合物群は、再結晶によって容易に光学純度をほぼ純粋にすることができ、脱スルホニル化を行なうことによって、光学活性アミン、β-アミノ酸類の不斉合成に成功しました。
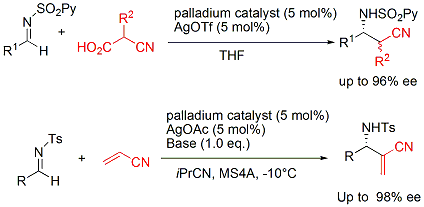
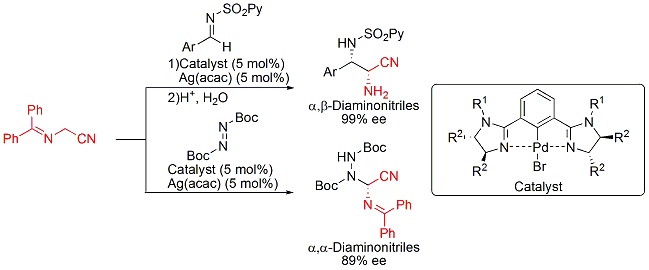
また、CN(シアニド)の不斉求核付加反応(Strecker型反応)にも成功し、光学活性α-アミノ酸およびα,βジアミン類縁体の不斉合成にも成功しました。
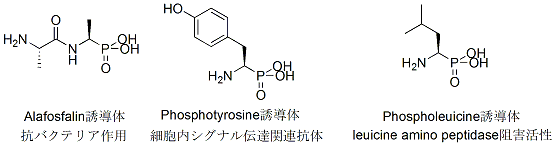
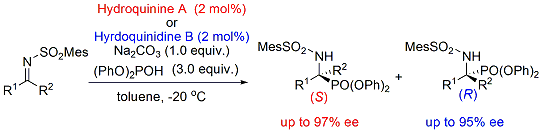
また、α-アミノリン酸誘導体は生理活性物質やその合成中間体として非常に重要な役割を果たし、その効率的合成法の確立が求められています。(下図参照)
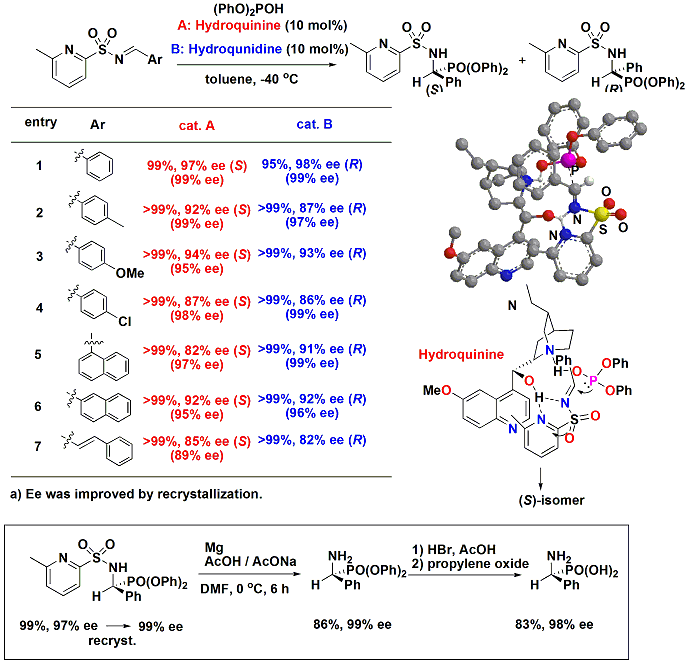
そこで、ヘテロアレーンスルホニルイミン類への亜リン酸の付加反応を検討した所、有機触媒としてキナアルカロイド類を用いることにより高度の立体制御が可能となることが明らかとなりました。この場合、有機触媒の構造を少し変化させるだけで、両エナンチオマーを高エナンチオ選択的に合成でき、再結晶、脱保護を経ることで、光学的に純粋なα-アミノリン酸を合成することに成功しました。
本手法を応用することにより、世界で初めてケトン由来のイミンへの亜リン酸エステルの付加による光学活性四置換α-アミノリン酸エステル類の合成に成功しました。また、この手法は、世界ではじめてのケトン由来イミンへのヘテロ原子の不斉求核付加の例でもあります。
さらに、窒素上が無保護のピロールのイミンへのaza-Friedel-Crafts反応や、四置換不斉炭素を有するイミダゾリン環形成反応も世界で始めて高エナンチオ選択性の発現に成功しております。
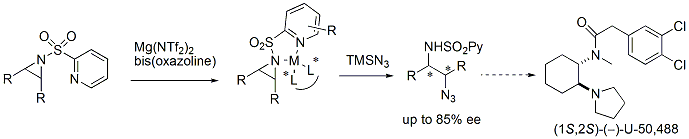
次に、ヘテロアレーンスルホニル基をアジリジンの活性化基として導入して不斉開環反応を行ってみました。ピリジンスルホニル基を導入したアジリジンをアジド(N3-)で開環反応し、その後、化学的変換をすることで、痛みを感じるκ-オピオイド受容体に選択的に作用するU-50,488の不斉合成にも成功しました。
2.ヘテロアレーンスルホニル基を有する新規不斉触媒創成
最近では、不斉有機触媒は金属触媒を使わないグリーンケミストリー手法の一つとして広く研究されています。
そこで、1.で開発したヘテロアレーンスルホニル基を不斉触媒に組み込み、新しい不斉有機触媒としての利用を検討しました。
まず、天然アミノ酸であるプロリンに、このピリジンスルホニル基を導入し、2,4-ジブロモイサチンへのアセトンの不斉アルドール反応に用いてみると、高エナンチオ選択的に(R)-コンボルタマイジンAの合成に成功しました(下図)。
この(R)-コンボルタマイジンAはヒト急性骨髄性白血病細胞への抗がん剤として期待されている化合物です。
また、この触媒は、アセトアルデヒドのアルドール反応においても高立体選択的に反応を進行させる触媒であり、この場合、コンボルタマイジンEやBの合成が可能であることも分かりました。
また、アセトアルデヒドの有機触媒による不斉アルドール反応は、これまで有効な触媒が存在しませんでしたが、この触媒を用いることで、世界で始めて「アセトアルデヒドのケトン類へのアルドール反応」に成功しました。
さらに、この触媒は、非常に少ない触媒量で反応を進行させることができるため、現在、東京化成工業株式会社より市販されています。[中部TLOニュース][東京化成工業株式会社で発売中]
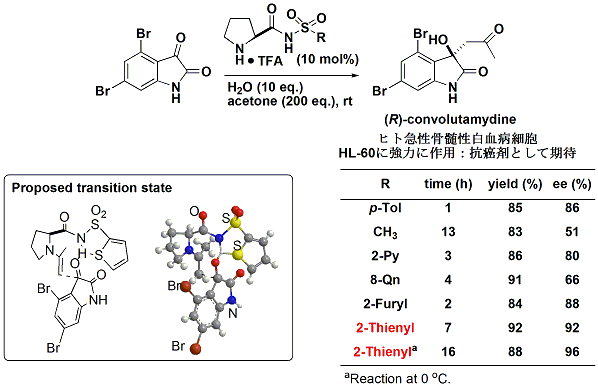 |
反応の遷移状態とそのHOMO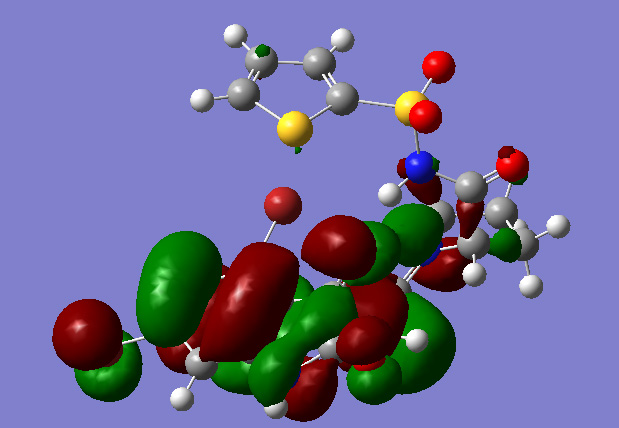 |
市販化されている 触媒  |
また、層状粘土化合物モンモリロナイトに、この触媒を担持し回収再利用を容易にした”環境調和型固相担持有機触媒”の開発にも成功しています。このような触媒の構造を分子軌道計算を行い解明したところ、水素結合が非常に重要な役割を果たしていることが明らかになりました。
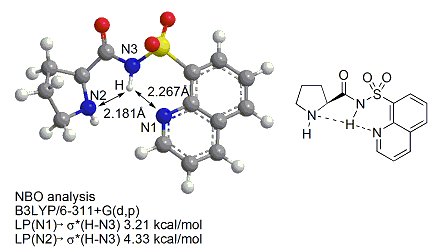
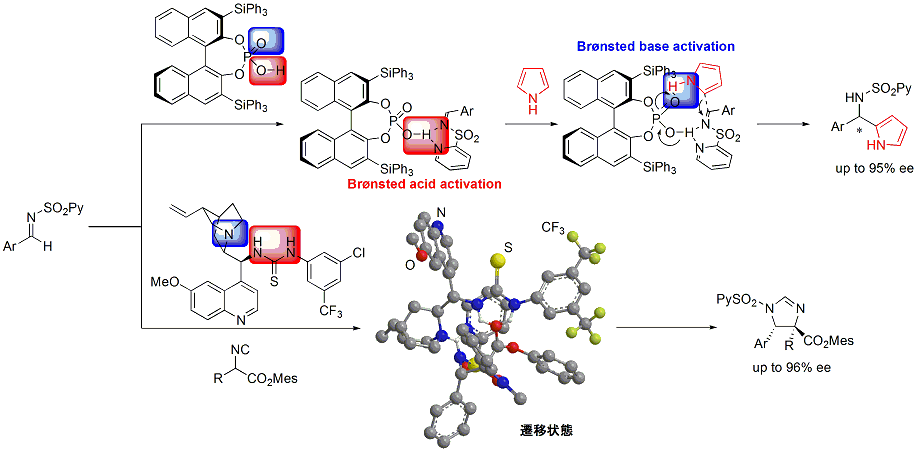
また、ヘテロアレーンスルホニル基を有するシンコナアルカロイド触媒も開発し、これを用いるイサチン類への脱炭酸型エナンチオ選択的Mannich反応にも成功しています。この反応は、脱炭酸型Mannich反応を用いて、ケチミン類に高エナンチオ選択的Mannich反応を行った世界ではじめての例となります。この生成物は、生理活性物質であるAG-041Rの合成へと展開し、同様の手法を用いて、生理活性物質である(−)-Flustraminol Bの合成にも成功しています。さらには、サッカリン由来のイミンに対して反応を行うことで、光学活性スルタムの合成にも成功しています。
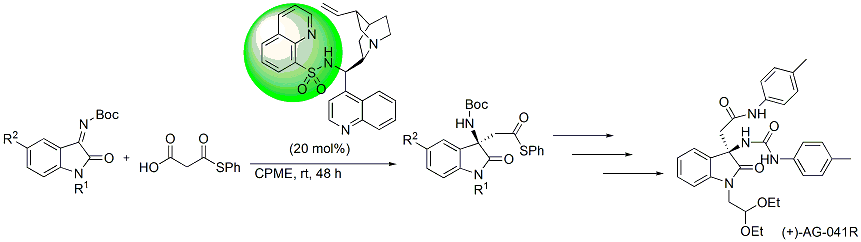
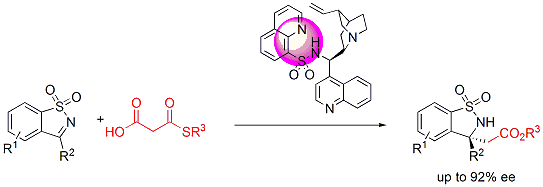
また、最近では、ケトン由来のケチミンに対するチオール、ヒドロペルオキシドの世界初の高立体選択的付加反応の開発にも成功しています。
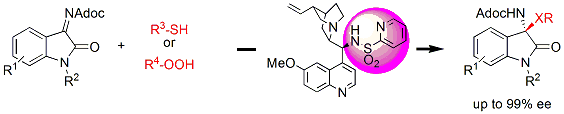
また、最近では、ヘテロアリールカルボニル基を導入した触媒の開発にも成功し、アジリジンの亜リン酸による世界初のエナンチオ選択的開環反応によるβ-アミノホスホン酸の合成にも成功しています。
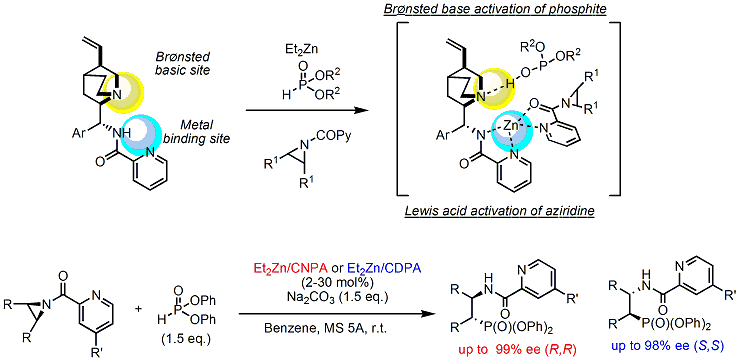
ここで得られるβ-アミノホスホン酸は、下記に示すように生理活性物質として非常に重要な物質でしたが、これまでにあまりよい合成法は存在せず、本手法は有効な合成法を提案したと言えます。
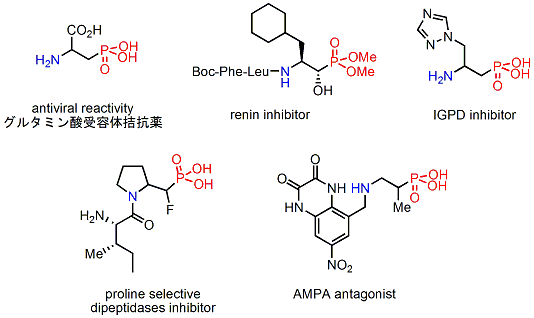
また、このピコリノイル化キナアルカロイド触媒は、酢酸銅と組み合わせて使用することで、ケチミン類へのビニロガスマンニッヒ反応も可能とし、また、イソシアニドとの反応を行うことで、高立体選択的にイミダゾリン化合物を合成することができます。
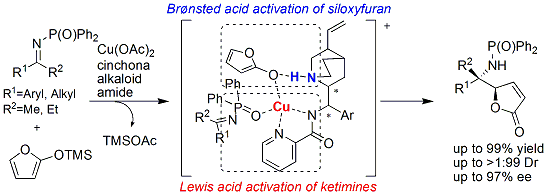
これらのヘテロアレーンスルホニル化触媒(リンク)およびヘテロアレーンカルボニル化触媒(リンク)(リンク2)も東京化成工業株式会社より発売されております。
3.新規イミダゾリン含有不斉触媒の開発
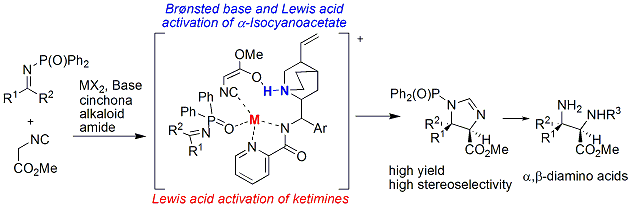
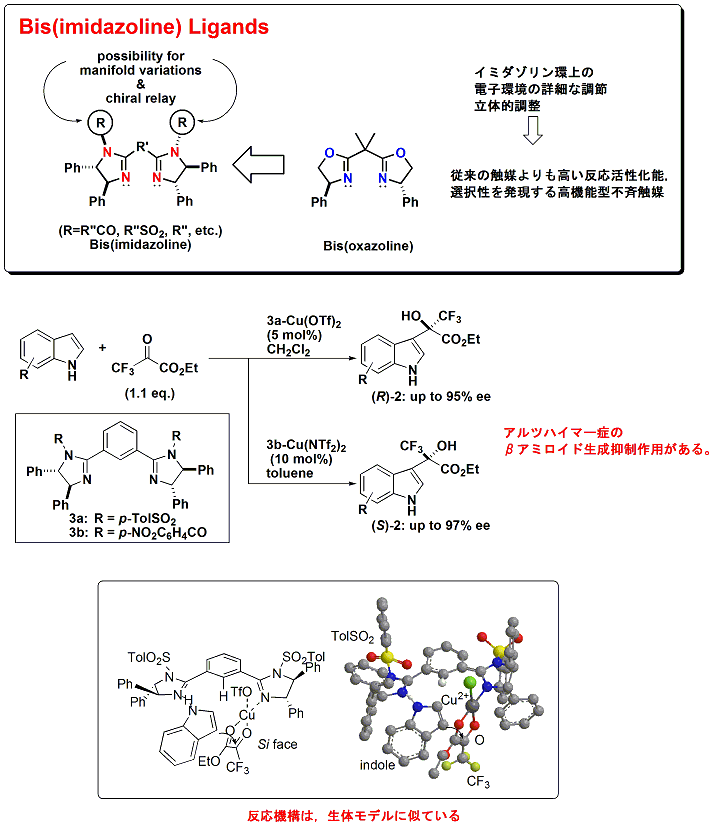
我々は、これまでにビスオキサゾリンを用いる不斉合成反応をいくつも開発し、その能力を示してきましたが、それと同時に、いくつかの限界も感じてきました。その限界の一つは不斉環境の詳細な調整です。その点を解決するために、新規のビスイミダゾリン配位子を設計・合成しました。合成した配位子を触媒にして不斉Friedel-Crafts反応を行なったところ、高エナンチオ選択性を与えることが明らかとなりました(下図)。また、反応条件を少し変化させるだけで、両エナンチオマーを高エナンチオ選択的に合成することに成功しました。この反応によって得られる生成物は、アルツハイマー症の原因物質であるβ-アミロイドの生成抑制作用があり、生理活性物質合成としても重要な合成法となります。
また、近年、環境調和型合成技術として注目を集めている三成分連結型反応の例として、このビスイミダゾリン触媒を用い、アルデヒド、アミン、アルキンの三成分連結型反応を行なったところ、高エナンチオ選択的に光学活性プロパルジルアミンを合成することにも成功しました。
これまでに報告されている合成法では、アルキンの置換基がアルキル基の時は、高エナンチオ選択性を発現させるのは非常に難しかったのですが、この不斉触媒を用いると高度な立体制御が可能となることが明らかとなりました。
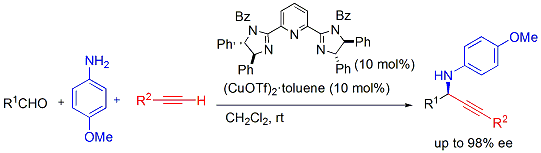
また、この触媒の窒素上の置換基を調整すると、水中にて不斉三成分アルキニル化反応を可能とする触媒になりました。本触媒は、SDSの添加で反応が加速し、エマルジョン中で反応が進行しています。水中反応で脱水反応を伴う三成分連結反応を行うことは、困難であるため触媒構造の調整が非常に効果的であることが明らかになりました。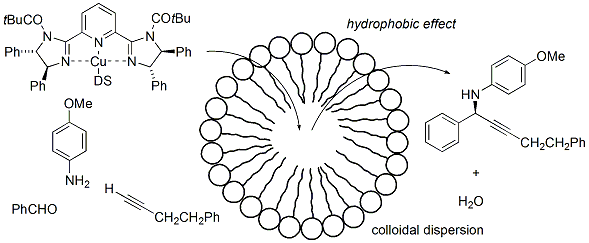
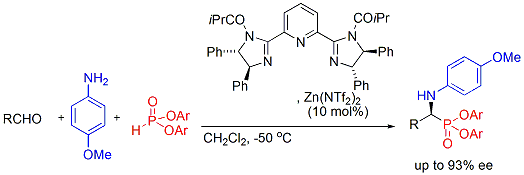
さらに、アルデヒド、アミン、亜リン酸エステルの三成分連結型Kabachnik-Fields反応を検討したところ、
高エナンチオ選択的にα-アミノリン酸エステル類が得られることも明らかとなりました。
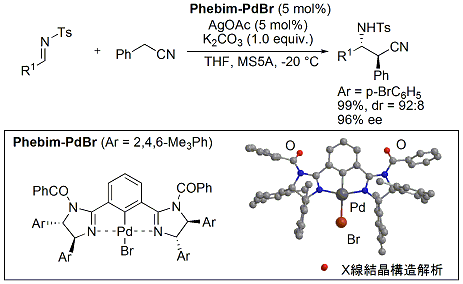
さらに、一価のアニオン性配位子であるピンサー型配位子としてビスイミダリンを用い、中心金属にPdを使用することによりベンジルシアニドのイミンへの不斉求核付加反応の開発にも成功しています。得られる生成物は、有用生理活性物質に誘導可能なβ-アミノニトリル化合物です(下図)。
このピンサー型触媒も、高度な立体制御能が認められ、現在、東京化成工業株式会社より市販されています。[触媒発売][テクニカルアイ]
また、これらの開発した試薬は、名工大生協2Fのモニュメント内にも展示されています。
 |
 |
また、本触媒を使った脱炭酸型シアノメチル化反応およびアクリロニトリルの高エナンチオ選択的aza-Morita-Baylis-Hillman反応の開発にも成功しました。
両反応とも我々の開発した不斉触媒によって初めて高度の立体選択性の発現に成功した例となっています。
得られた生成物からPDE-4阻害剤の合成にも成功しました。
また、様々なα-ヘテロアセトニトリルの不斉反応にも適応可能であることを、世界ではじめて明らかにしています。
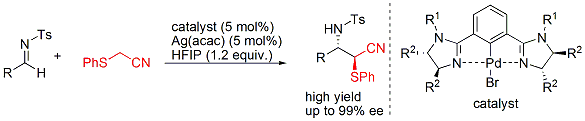
また、イサチンから誘導されるケチミンへのアリル化反応にも利用ができることが明らかにしました。ケチミンへの触媒的不斉アリル化反応は、これまでに1例しか報告されておらず、本手法が世界で2例目の報告となります。
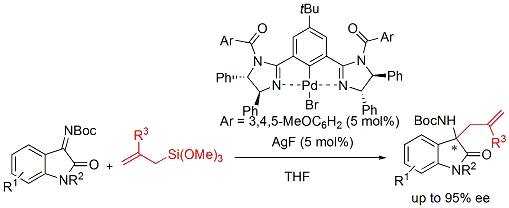
さらに最近では、イミダゾリンを光学活性リン酸触媒に導入することで、これまで困難とされてきたアジリジンのチオシアネートによる開環反応の開発にも成功しました。
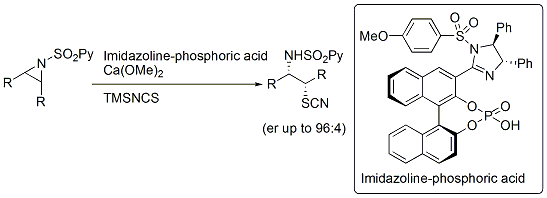
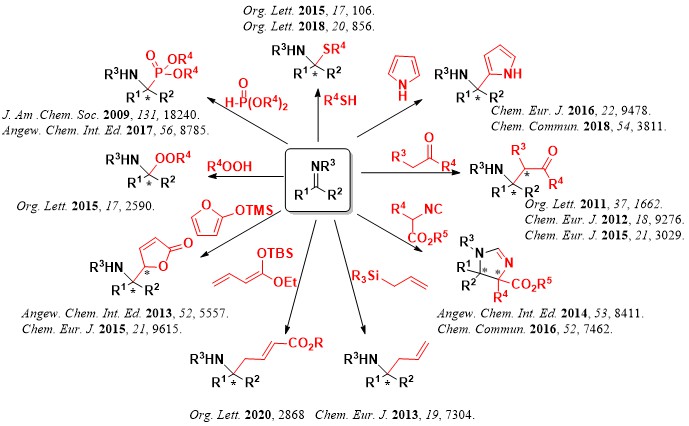
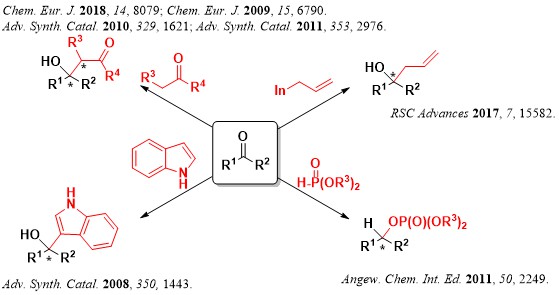
4.四置換不斉炭素の構築
医農薬品には、四つの異なる置換基を有する”四置換不斉炭素”が、骨格中に含まれる化合物が数多く存在します。しかしながら、この”密”な四置換不斉炭素を効率的に合成する手法は、未だ未解決な課題となっており、医農薬品の発展を妨げています。
もし、四置換不斉炭素を効率的、自在に構築できるようになったら、我々のライフサイエンス、クオリティーオブライフ(QOL)の向上につながるのではないか・・・・そう考えて、我々が上記に開発した”新しい””高活性””立体制御可能”な不斉触媒を用いて、困難な四置換不斉炭素構築に挑んできました。
世界で求められながらも達成不能であったいくつもの合成手法の開発に成功しています。
要約を下の図に示します。
・四置換光学活性アミンの合成
・四置換光学活性アルコールの合成
これ以外にも進行中のテーマが多数あります。
これらの研究に興味を持った人、配属、受験を希望する人はこちらから連絡を取ってくだされば、可能な限り早く返答いたします。
中村研で開発され、市販化された試薬
1.チオフェンスルホニルプロリンアミド触媒(リンク)(写真)(紹介文)(カレンダー)(不斉有機触媒総合カタログ)(カタログ2)
2.ビスイミダゾリンPd触媒(リンク)(写真)(紹介文)
3.ピコリノイル化シンコニンアミド触媒(リンク)(写真)(紹介文)
4.ピコリノイル化シンコニジンアミド触媒(リンク)(紹介文)
5.キノリンスルホニル化シンコニジン触媒(リンク)(紹介文)
6.イミダゾリンリン酸触媒。(リンク)(紹介文)