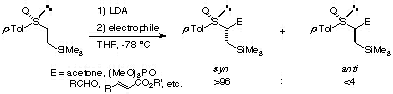
β-シリルエチルスルホキシドと求電子試薬の反応
こちらには、主に2006年以前の少し古い研究内容をまとめておきます。
まず、当研究室では、有機硫黄化合物の特性を最大限に生かした不斉合成反応の開発を目的にしていました。
(A)ケイ素とカルボニル酸素の相互作用を利用したβ-シリルエチルスルホキシドのジアステレオ選択的反応の合成的応用と立体選択性発現機構の解明
(A)光学活性スルホキシドのα-スルフィニルカルボアニオンを用いた不斉誘導は数多く検討されていますが、立体選択性はスルホキシドの構造に依存するため、必ずしも満足のいく選択性は得られていません。そこで、この困難に打ち勝つべくスルホキシドのβ位に不斉制御因子としてシリル基を導入した基質を設計し、そのα-カルボアニオンと種々の求電子剤との反応の検討を行いました。その結果、スルホキシドのα位において高立体選択的に反応が進行することを見いだしました[ref 1]。このようなスルホキシドのα-カルボアニオンにおいて高度の立体選択性が得られた例は報告されていませんでした。
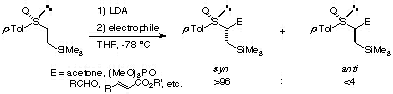
 この高度の立体選択性の制御機構を解明するために、スルホキシドのβ位の置換基を種々検討した結果、この立体選択性発現にはβ位のシリル基が必須であり、右の図に示す6員環遷移状態においてケイ素とカルボニル酸素が相互作用することにより高立体選択性を発現するという、これまでにないケイ素-酸素相互作用を提唱するに至りました。またこの相互作用は、分子軌道計算を用いた遷移状態の評価によっても支持されました。
この高度の立体選択性の制御機構を解明するために、スルホキシドのβ位の置換基を種々検討した結果、この立体選択性発現にはβ位のシリル基が必須であり、右の図に示す6員環遷移状態においてケイ素とカルボニル酸素が相互作用することにより高立体選択性を発現するという、これまでにないケイ素-酸素相互作用を提唱するに至りました。またこの相互作用は、分子軌道計算を用いた遷移状態の評価によっても支持されました。
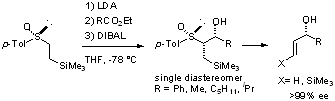
また、このα-カルボアニオンとエステルを反応させ、そのままDIBAL還元を行うと、完全に立体制御された生成物が得られ、スルフィニル基を除去することにより効率的な光学活性アリルアルコールの合成が行えました。[ref 2]
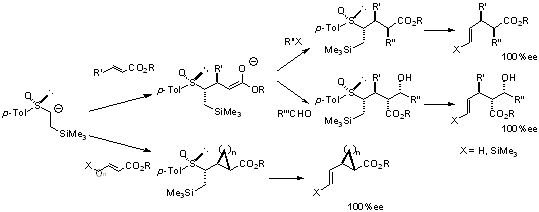
さらに、この基質はα,β-不飽和エステルとのMichael付加(1,4-付加)反応において、生成する二つの不斉中心を完全に制御して反応は進行し、さらに中間体エノラートのアルキル化およびアルデヒドとの反応においても完全に立体制御された単一ジアステレオマーのみを与えます(下式)。これは、スルホキシドの1つの不斉中心によって新たに生じる4つの不斉中心を完全に制御できるという驚くべき立体制御法です。また、中間体エノラートの分子内環化反応においても、単一ジアステレオマーの環化生成物が高収率で得られます。得られた生成物は位置選択的にスルフィニル基とシリル基の間で脱離反応を行うことができ、ビニル化合物およびビニルシラン化合物へと容易に変換できるため、本基質はキラルビニルアニオン等価体として非常に有用です。さらに、この合成法を利用して光学的に純粋なtrans-菊酸誘導体の初の簡便な合成に成功しています。また、Herndonらは、我々が開発したβ-シリルエチルスルホキシドの反応を用いて、ステロイド骨格の構築へと展開しています[ref 3]。
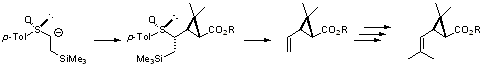
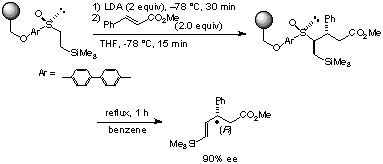
また、近年、医薬品等の開発において、簡便に多種の化合物を合成するために、コンビナトリアルケミストリーと言う概念が発達しております。そこで、この我々の開発したβ-シリルエチルスルホキシドのさらなる発展を目指し、β-シリルエチルスルホキシドを固相(ポリマー)に担持し、同様の反応を行ったところ高い光学純度で光学活性エステルが得られました。この手法は、固相上にスルホキシドを担持しているために、反応に用いた余分な試薬を洗い流すだけで精製ができるという大きな利点を持っています[ref 4]。
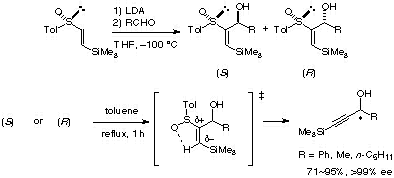
また、このβ-シリルスルホキシドの一種と言えるビニルスルホキシドを用いて求電子剤との反応を行い、付加生成物のジアステレオマーをカラムクロマトグラフィーで分割後、スルフィニル基の除去を行ったところ、それぞれの光学活性プロパルジルアルコールを得ることができました。このような、ビニルスルホキシドからのスルホキシドの脱離による三重結合の形成が非常に温和な条件で進行することは非常に珍しく、この反応が起こる理由を分子軌道計算を用いて調べてみました。するとケイ素原子のβ位のカチオンを安定化する効果が、脱離反応の遷移状態を安定化し、反応を加速していることが明らかになりました。つまり本反応試薬は「キラルアセチリド等価体」ということができます[ref 5]。
(B)炭素-硫黄結合軸の回転障壁を利用した新しい不斉合成反応の開発
また、先程示したβ-シリルエチルスルホキシドのアリール基としてかさ高いトリイソプロピルフェニル基を導入すると、立体選択性が逆転しanti体が主生成物として得られることが明らかになりました。このような、硫黄官能基上の立体的なかさ高さと立体制御の関係を解明する目的、および、硫黄官能基を用いた新規不斉制御法の開発をめざし、炭素-硫黄結合軸の回転障壁を利用した新しい不斉合成反応の検討を行いました。その結果、かさ高いアリールスルフィニル基として2,4,6-トリイソプロピルフェニルスルフィニル基を有する1-スルフィニル-2-アシルナフタレンへの求核付加、向山アルドール反応および還元反応において高立体選択的に反応が進行することが明らかになりました。これらの反応は、炭素硫黄結合軸の回転障壁を利用した初の不斉合成法です。またGrignard試薬との反応によって得られた生成物はスルフィニル基を容易に除去でき光学活性2級アルコールへと変換できます。さらに、ナフチルイミンと有機リチウム試薬の反応では、完全に立体制御して反応が進行し、光学活性2級アミンの合成ができました。この反応の特徴は、(1)光学活性スルホキシドを用いているため、基質の回転異性体を分離する必要がなく、また、(2)スルフィニル基を反応後、簡便に除去できる点で、回転異性体を予め分離してから不斉反応を行う必要がある従来の回転障壁を利用した反応とは全く異なり、極めて有用な不斉合成法です[ref 6]。
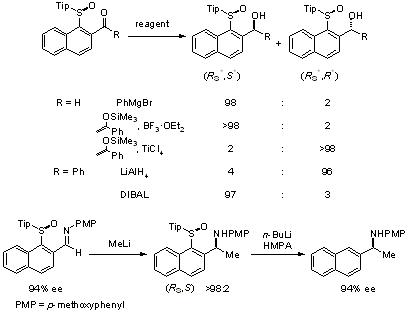
C-S軸不斉を用いる不斉合成反応
さらにここで用いた2,4,6-トリイソプロピルフェニルスルフィニル基は、遠隔位での不斉誘起に有用であることも明らかになりました。すなわち、2,4,6-トリイソプロピルフェニルスルフィニル基を有するベンズアルデヒドへの求核付加反応および還元反応は高立体選択的に進行し、この反応はスルフィニル酸素とカルボニル酸素の金属イオンへのキレーションが重要な役割を担っていることが明らかになりました(下図)。また、この生成物も簡便にスルフィニル基を除去することができ、抗ヒスタミン剤のneobenodineの前駆体を高エナンチオ選択的に合成することができました[ref 7]。
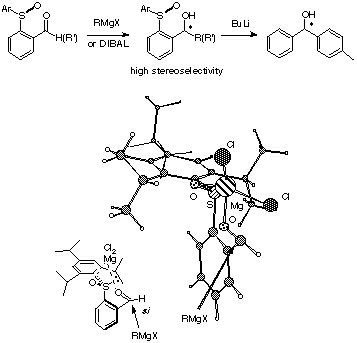
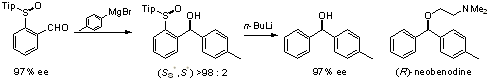
スルフィニルベンズアルデヒドへの高立体選択的反応
さらに、2,4,6-トリイソプロピルフェニルスルフィニル基を用い、従来、高度の立体選択性を得ることができないと言われていた鎖状γ-ケトスルホキシドのカルボニル基の還元反応を行ったところ、還元剤としてDIBALを用いることによって高度の立体選択性が得られることが明らかになりました[ref 8]。
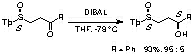
γ-ケトスルホキシドの不斉還元反応
また、スルフィニル基をルイス塩基として用いる新規不斉配位子を設計し、アリル位置換反応において68%eeのエナンチオ選択性の発現に成功しました[ref 9]。
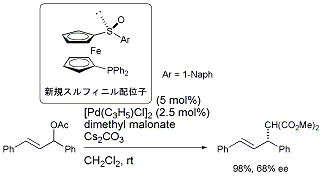
新規スルフィニル不斉配位子の設計と反応
さらには,この種の化合物を効果的に合成するために,光学活性スルフィナートの高エナンチオ選択的合成にも成功しています[ref 10]。
(C)アキラルなスルフィドの隣接カルボアニオンを用いる高エナンチオ選択的反応の開発とそのエナンチオ選択性の発現機構の解明
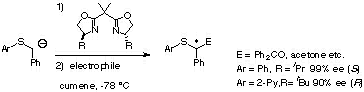
また硫黄上に酸素原子のないスルフィドを用いた不斉合成手法の開発をめざし、スルフィドのα-カルボアニオンの立体選択的反応の検討を行いました。このカルボアニオンの反応は、スルホキシドのように硫黄上に不斉点が存在しないために、外部からの不斉の挿入、すなわちエナンチオ選択性の発現法の開発が必須となります。そこで、このスルフィドのα-カルボアニオンの「立体配置の安定性が低い」という特徴に注目し、この特徴を利用したエナンチオ選択的反応の開発を検討しました。その結果、ベンジルフェニルスルフィドのα-カルボアニオンと種々の求電子剤との反応において、不斉配位子としてビスオキサゾリンを用いることにより、スルフィドのα位に99%
eeのエナンチオ選択性が発現することが明らかになりました。このような高エナンチオ選択性の発現はα-ヘテロカルボアニオンとしては珍しく、特に、スルフィドにおいてこのような高度な不斉誘起に成功したのは世界で初めての例です。そこで、この反応におけるエナンチオ選択性の発現機構を詳細に検討したところ、dynamic
kinetic resolution、つまり反応の遷移状態における安定性の相違によってエナンチオ選択性が発現していることが明らかとなりました。またさらに、分子軌道計算を行うことにより得られた高エナンチオ選択性を合理的に説明することができました[ref 11]。
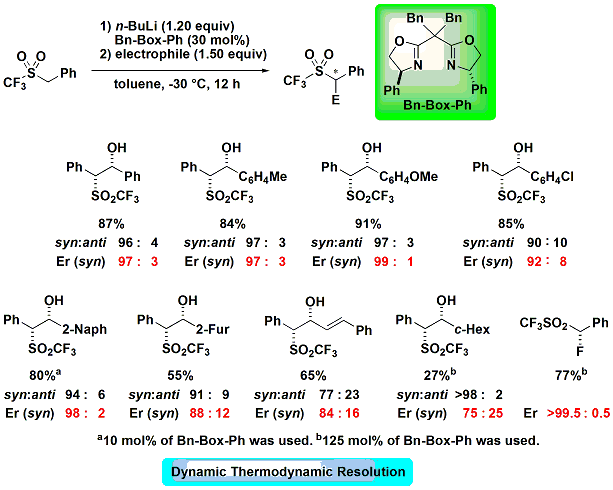
さらにこのスルフィドのアリール基を2-ピリジル基へと変換したところ、誘起される立体が逆転すること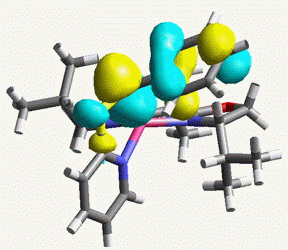 が明らかになりました。このような立体反転現象は極めて珍しく、反応機構の詳細な検討を行ったところ、ベンジル2-ピリジルスルフィドのエナンチオ選択性はdynamic
thermodynamic resolutionで発現しており、リチウムの立体反転を伴って反応が進行するという興味深い結果が得られました。この結果は分子軌道計算を用いこの錯体のHOMOを計算したところ炭素-リチウム結合の裏側に求核性の電子雲が存在することが確認でき、カルボアニオンの反転を伴う反応経路を証明することができました(右図)。
が明らかになりました。このような立体反転現象は極めて珍しく、反応機構の詳細な検討を行ったところ、ベンジル2-ピリジルスルフィドのエナンチオ選択性はdynamic
thermodynamic resolutionで発現しており、リチウムの立体反転を伴って反応が進行するという興味深い結果が得られました。この結果は分子軌道計算を用いこの錯体のHOMOを計算したところ炭素-リチウム結合の裏側に求核性の電子雲が存在することが確認でき、カルボアニオンの反転を伴う反応経路を証明することができました(右図)。
また、この新規不斉合成手法の展開として、容易に除去できる2-キノリル基を有するスルフィドを用いエナンチオ選択的反応を行い、脱キノリル化反応を行ったところ、光学活性チオールを高い光学純度で得ることができました[ref 12]。
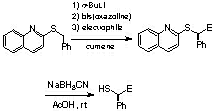
さらにはアリルスルフィド[ref 13]、セレニド[ref 14]、ジチオアセタール、 N,S-アセタール[ref 15]を用いた反応においても高い立体選択性の発現にも成功しています。また,この不斉反応を利用した軸不斉オレフィンの合成およびカルバサイクリン誘導体の合成も行っています[ref 16]。また,ドイツのDieter Hoppe研と共同研究による新反応開発も行ないました[ref 17]。
以上のように、我々は高エナンチオ選択的なスルフィド類のα-カルボアニオンを用いる不斉合成反応の開発に世界で初めて成功しています。
一方で、合成的に重要な化合物であるスルホンのカルボアニオンを用いるエナンチオ選択的反応は、これまでに高いエナンチオ選択性が得られた例はありませんでした。そこで、スルホンのカルボアニオンを用いるエナンチオ選択的求電子付加反応を検討した所、不斉配位子としてビスオキサゾリン類を用いると高エナンチオ選択的に反応が進行することが明らかとなりました。
有機リチウムと不斉配位子を用いる脱プロトン化-置換反応で、不斉源の触媒化は非常に難しいことが知られていますが、この反応はビスオキサゾリン類を触媒的に用いても、高度のエナンチオ選択性を与えます。
また、この反応機構を分子軌道計算、核磁気共鳴スペクトル、ESI-マススペクトルなどを用いて詳細に調べると、この反応は触媒的なDynamic thermodynamic resolution機構で進行していることが明らかになりました。
このような触媒的な反応経路もこれまでに報告例はなく、非常に興味深い結果です。
なお、本研究は名古屋工業大学で行われたものであり、研究の推進に非常に多くの学生の献身的な協力を頂きましたことをここに示し、厚く感謝いたします。
[卒業生]
| ref 1 | Shuichi Nakamura, Hirofumi Takemoto, Yoshio Ueno, Takeshi Toru, Terumitsu Kakumoto, Tsuneo Hagiwara, J. Org. Chem.2000, 65, 469-474.[Abstract] |
| ref 2 | Shuichi Nakamura, Jun-ichi Nakayama, Takeshi Toru, J. Org. Chem. 2003, 68(14), 5766-5768.[Abstract] |
| ref 3 | Takeshi Toru, Shuichi Nakamura, Hirofumi Takemoto, Yoshio Ueno, Synlett
1997, 449-450.(invited,
Special Issue: Dedicated to E. J. Corey)[Abstract] Shuichi Nakamura, Yoshihiko Watanabe, Takeshi Toru, J. Chem. Soc., Prekin Trans 1 1999, (23), 3403-3404.[Abstract] Shuichi Nakamura, Yoshihiko Watanabe, Takeshi Toru, J. Org. Chem.2000, 65, 1758-1766.[Abstract] |
| ref 4 | Shuichi Nakamura, Youhei Uchiyama, Satoshi Ishikawa, Ryuta Fukinbara, Yoshihiko
Watanabe, Takeshi Toru Tetrahedron Lett. 2002, 43, 2381-2383.[Abstract] |
| ref 5 | Shuichi Nakamura, Shinya Kusuda, Kiyoshi Kawamura, Takeshi Toru, J. Org. Chem. 2002, 67(3), 640-647.[Abstract] |
| ref 6 | Shuichi Nakamura, Hiroki Yasuda, Yoshihiko Watanabe, Takeshi Toru, Tetrahedron
Lett. 2000, 41, 4157-4160.[Abstract] Shuichi Nakamura, Hiroki Yasuda, Yoshihiko Watanabe, Takeshi Toru, J. Org. Chem. 2000, 65, 8640-8650.[Abstract] Shuichi Nakamura, Hiroki Yasuda, Takeshi Toru, Tetrahedron: Asymmetry 2002, 13, 1509-1518.[Abstract] Hideki Sugimoto, Shuichi Nakamura, Yoshihiro Shibata, Norio Shibata, Takeshi Toru Tetrahedron Letters 2006, 47(8), 1337-1340.[Abstract] |
| ref 7 | Shuichi Nakamura, Masahiro Oda, Hiroki Yasuda, Takeshi Toru, Tetrahedron2001, 57(40),8469-8480.[Abstract] |
| ref 8 | Shuichi Nakamura, Masayuki Kuroyanagi, Yoshihiko Watanabe, Takeshi Toru, J. Chem. Soc., Perkin Trans. 1 2000, 3143-3148.[Abstract] |
| ref 9 | Shuichi Nakamura, Takeo Fukuzumi, Takeshi Toru, Chirality 2004, 16(1), 10-12.[Abstract] |
| ref 10 | Shuichi Nakamura, Motoaki Tateyama, Hideki Sugimoto, Masaya Nakagawa, Yoshihiko
Watanabe, Norio Shibata, Takeshi Toru, Chirality, 2005, 17(2), 85-88.[Abstract] Norio Shibata, Mitsuharu Matsunaga, Masaya Nakagawa, Takeo Fukuzumi, Shuichi Nakamura, Takeshi Toru J. Am .Chem. Soc. 2005, 127,1374-1375.[Abstract] Norio Shibata, Mitsuharu Matsunaga, Takeo Fukuzumi, Shuichi Nakamura, Takeshi Toru, Synlett 2005, (11), 1699-1702.[Abstract] |
| ref 11 | Shuichi Nakamura, Ryo Nakagawa, Yoshihiko Watanabe, Takeshi Toru, Angew.
Chem. Int. Ed., 2000, 39, 353-355.[Abstract] Shuichi Nakamura, Ryo Nakagawa, Yoshihiko Watanabe, Takeshi Toru, J. Am. Chem. Soc. 2000, 122, 11340-11347.[Abstract] |
| ref 12 | Shuichi Nakamura, Akinori Furutani, Takeshi Toru, Eur. J. Org. Chem. 2002, (10), 1690-1695.[Abstract] |
| ref 13 | Shuichi Nakamura, Toru Kato, Haruka Nishimura, Takeshi Toru, Chirality 2004 16(2), 86-89.[Abstract] |
| ref 14 | Shuichi Nakamura, Takayuki Aoki, Takahiro Ogura, Libo Wang, Takeshi Toru , J. Org. Chem. 2004, 69(25), 8916-8923.[Abstract] |
| ref 15 | Shuichi Nakamura, Yuji Ito, Libo Wang, Takeshi Toru, J. Org. Chem.2004, 69(5), 1581-1589.[Abstract] Libo Wang, Shuichi Nakamura, Takeshi Toru, Org. Biomol. Chem. 2004, 2(15), 2168-2169.[Abstract] Libo Wang, Shuichi Nakamura, Yuji Ito, Takeshi Toru, Tetrahedron: Asymmetry 2004, 15(19), 3059-3072.[Abstract] |
| ref 16 | Shuichi Nakamura, Takahiro Ogura, Libo Wang, Takeshi Toru, Tetrahedron Lett. 2004, 45(11), 2399-2402.[Abstract] Libo Wang, Shuichi Nakamura, Norio Shibata, Takeshi Toru, Chem. Lett. 2005, 34(1), 76-77.[Abstract] |
| ref 17 | Ralf Otte, Birgit Wibbeling, Roland Frohlich, Shuichi Nakamura, Norio Shibata,
Takeshi Toru, and Dieter Hoppe Tetrahedron Lett. 2007, 48, 8636-8642.[Abstract] Heiko Lange, Klaus Bergander, Roland Frohlich, Seda Kehr, Shuichi Nakamura, Norio Shibata, Takeshi Toru, Dieter Hoppe Chem. Asian J. 2008, 3(1), 88-101.[Abstract] |
| その他 | Shuichi Nakamura, Toshinobu Hayakawa, Tatsuya Nishi, Yoshihiko Watanabe,
Takeshi Toru, Tetrahedron2001, 57(31),6703-6711[Abstract] Shuichi Nakamura, Naoki Sato, Masashige Sugimoto, Takeshi Toru, Tetrahedron: Asymmetry 2004, 15(9), 1513-1516.[Abstract] Nobuyuki Mase, Yoshihiko Watanabe, Koji Higuchi, Shuichi Nakamura, and Takeshi Toru J. Chem. Soc. Perkin Trans. 1 2002, 2134-2136.[Abstract] Hideki Sugimoto, Shuichi Nakamura, Yoshihiko Watanabe, Takeshi Toru, Tetrahedron: Asymmetry 2003, 14, 3043-3055.[Abstract] Hideki Sugimoto, Makoto Kobayashi, Shuichi Nakamura, Takeshi Toru, Tetrahedron Lett. 2004, 45(22),4213-4216.[Abstract] |