
�i�m���q�������H
-�i�m���ʂւ̍��ړI�Ȓu����z�u���\�ɂ��镪�q�y��Ƃ��ẴV�N���f�L�X�g����-
�y�f�̂悤�ȍ��x�ȋ@�\�������悤�Ƃ���Ȃ�A�f�V�i�m���[�^�̒P�ʂŐ����Ɋ��\�����Ԕz�u����K�v������B
����͌��݂̉Ȋw�Z�p�������Ă��Ă��e�ՂłȂ����Ƃ������B
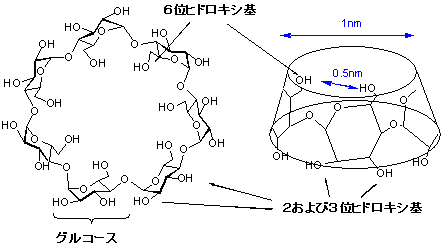
�@�����Œ��ڂ����̂��A���V�N���f�L�X�g�����ł���B���̓������q�̓O���R�[�X����Ɍ��������~���\�������B
���̉~���̏㉺���ꂼ��̖ʂ̒��a�͖�P�i�m���[�g���ł���A����������悤�ɃO���R�[�X�̃q�h���L�V����Ԋu�ő��݂���i�}�P�j�B
���������āA���̃q�h���L�V������w�����ɂ���ēK�Ȓu����ɕϊ�����A�ړI�Ƃ��銯�\��̏W�ρE�z�u���Ɏ�������
�i�m���q�邱�Ƃ��ł���B
|
| �}1. ��-�V�N���f�L�X�g���� |
�����Ńq�h���L�V����X���z���_�G�X�e���������V�N���f�L�X�g�����U���̂����������B
�X���z�j���I�L�V��͗ǍD�ȒE����ł���A��������j�܂Œu�����邱�ƂŊ��\��e�Ղɓ����ł���B
�����ł���ɏd�v�Ȃ̂́A�V�N���f�L�X�g������ɑ��݂��镡���̃q�h���L�V����ʒu���ٓI�ɃX���z���_�G�X�e�������邱�Ƃł���B
���ꂪ�����ł���A��]���鐔�̊��\����A��]����ʒu�ɓ����ł��A����ɂ��i�m���ʏ�ɈӐ}�������\��̋�Ԕz�u��
�����q����������B
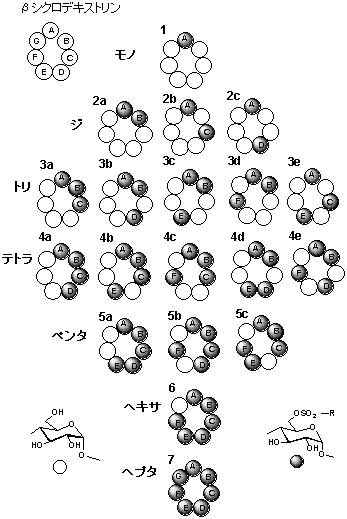
�V�̃O���R�[�X����Ȃ���V�N���f�L�X�g�����ɂ́A�V�̂U�ʃq�h���L�V��牏���ꂽ�i�m���ʂ����݂���B
���̂��߁A�P�`�V�̃X���z���_�G�X�e�������\�ł���A����ɂQ�`�T�̃X���z�j����������ꂽ�ꍇ�ɂ͈ʒu�ِ��̂������A
���̌��ʂƂ��ĂP�X��ނ̂U�ʃX���z���_�G�X�e�������݂���i�}�Q�j�B
���\��̖]�݂��邷�ׂĂ̔z�u���\�ɂ��邽�߂ɂ���炷�ׂĂ��ł̉������ׂ��ő�̉ۑ�́A
�ʒu�ِ��̂̕��������ƍ\������ł������B
 |
 |
�}2. 6-O-�X���z�j����b-�V�N���f�L�X�g������
���̈ʒu�ِ��� |
�}3. �y���^�X���z�i�[�g5a-e�̍\������ |
�P�X�W�S�N�ɊJ�n���ꂽ���c��̌����i�W�`�g���X���z�i�[�g�j���Ђ����������Ō����𐋍s���A�܂��T�̃X���z�j���������
�y���^�X���z�i�[�g�̂R��̈ʒu�ِ��̂Ɏ��g�B�����̕��������ɂ́A�t���J�����N���}�g�O���t�B�[�ɂ�萬�������B
�����āA�ʒu�ِ��̂̍\������ɂ́A�X���z�j�����O���R�[�X�c��q���E�X���z���_�����łR,�U�A���q�h���������U���̂��h�����̌��g�ƂȂ����B
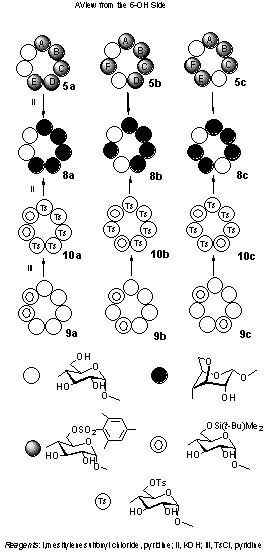
�܂��A�y���^�X���z�i�[�g5a-c���瓾��ꂽ�R,�U�A���q�h�����U����8a-c (�}�R)���ꂼ��ɂ��āA������\�j���C���i�m�l�q�j�X�y�N�g����ŗׂ荇��
�O���R�[�X�c��̊W�������j�I�[�o�[�n�E�U�[���ʁi�m�n�d�j���ϑ����邱�Ƃ� (�}�S)�A���ꂼ��̗U���̔z������肵�A
���Ƃ̃X���z�i�[�g�ʒu�ِ��̂̍\���肵��(���\�_���P)�B���̍\��������m���߂�Ӗ��ŁA�L�@���w�I�\�����ւ��s����(�}�R)�B
�\�����m�ł�������q�h���L�V�t-�u�`���W���`���V���������ꂽ���V�N���f�L�X�g�����i������9a-c)�̎c��̂U�̃q�h���L�V���
�X���z�j�����i������10a-c)���A���������R,�U�A���q�h�������邱�ƂŁA�W�i�Ƃ��Ẳ�����8a-c�����������B
�����ƁA��ɉ�����5a-c���瓾�����̂��r�������邱�ƂŁA�m�n�d�����Ƃɍs�����\�����肪���������Ƃ��ؖ������B
�ʒu�ِ��̂��Ȃ��w�L�T�X���z�i�[�g6�ƃw�v�^�X���z�i�[�g7���������́A
�ꌩ�A�e�ՂɌ�����B�������A�w�v�^�X���z�i�[�g7�̏ꍇ�A�������ߏ�ɍs����
�h�W�Ԗځg�̃X���z�j�������Q�ʃq�h���L�V��ɋN����B���������āA
�����悭�w�v�^�X���z�i�[�g��ɂ́A�ቷ�i�}�C�i�X�S�O�x�j�ł̔������L���ł��邪�A
�����ɔ�ׂĒP���v�Z�łR�Q�{�̎��Ԃ������邱�ƂɂȂ�B�����Ŕ���������������q��
�������āA�L�������̓Y�����L���ł��邱�Ƃ����o���A����ɂ���ĂW�O����
�w�v�^�X���z�i�[�g���������������i���\�_���Q�j�B
�Ō�Ɏc��e�g���X���z�[�g4a-e�̂T��̈ʒu�ِ��̂ɂ��āA���̕����́A
�t���J�����N���}�g�O���t�B�[���܂��s���A���̌�ɏ����J�����N���}�g�O���t�B�[��
�������邱�ƂŐ��������B�����̍\������ɂ��ẮA������\�m�l�q����g����
�O���R�[�X�c��̂��ׂẴV�O�i�����s�n�b�r�x����тb�n�r�x�@�ŋA�����A
���̏�Ŏc��Ԃm�n�d���ϑ�����(�}�T)���ƂŁA�X���z�j�����O���R�[�X�Ɩ��C���O���R�[�X��
�Ԃ̔z��W�𖾂炩�ɂ��Đ��������i���\�_���R�j�B
�ȏ�ɂ��A�P�X�W�S�N���J�n���ꂽ�|���X���z�j�������V�N���f�L�X�g�����̌�����
�Q�R�N�ڂɂ����Ċ������A�P�`�V�̃X���z�j�����L����P�X��ނ��ׂĂ̗U���̂�
�P�i�m�������[�g����ɖ]�ފ��\��z�u���������邽�߂Ɏg�p�\�ɂȂ����B
|
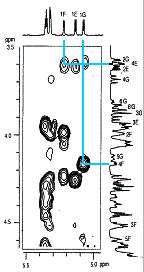 |
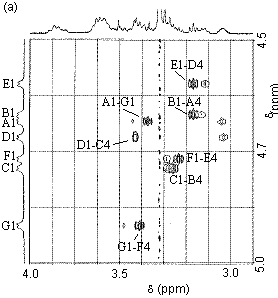
�}4.�y���^(3,6�A���q�h��)
�U����8b��ROESY�X�y�N�g�� |
 |
 |
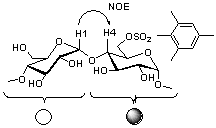 |
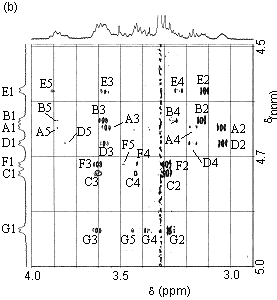
| �}5. �e�g���X���z�i�[�g4d��TOCSY(a)�����ROESY(b)�X�y�N�g�� |
���\�_��
1. H. Yamamura, D. Iida, S. Araki, K. Kobayashi, R. Katakai, K. Kano, M. Kawai, J. Chem. Soc., Perkin Trans 1 1999, 3111-3115.
2. H. Yamamura, J. Kawasaki, H. Saito, S. Araki, M. Kawai, Chem. Lett. 2001, 706-707.
3. H. Yamamura, H. Tashiro, J. Kawasaki, K. Kawamura, K. Masao, Tetrahedron 2007, 63, 2064-2069.








